
Johannes Diderik van der Waals (Leiden, Países Bajos, 23 de noviembre de 1837 - Ámsterdam, 8 de marzo de 1923) fue un profesor universitario y físico neerlandés galardonado con el Premio Nobel de Física en 1910.Hijo de Jacobus van der Waals y Elisabeth van den Burg. Fue profesor de una escuela y más tarde pudo asistir a la universidad, a pesar de su desconocimiento de las lenguas clásicas. Estudió entre 1862 y 1865, licenciándose en matemáticas y física. Se casó con Anna Magdalena Smit y tuvo cuatro hijos: tres mujeres (Anne Madeleine, la poetisa Jacqueline Elisabeth, Johanna Diderica) y un varón (el físico Johannes Diderik Jr).
En 1866, fue director de una escuela secundaria de La Haya. En 1873, obtuvo el grado de Doctor por sus tesis titulada "Over de Continuïteit van den Gas - en Vloeistoftoestand" (Sobre la continuidad de los estados líquido y gaseoso). En 1876, se convirtió en el primer profesor de física de la Universidad de Ámsterdam.
Investigaciones científicas
Ecuación de Van der Waals
La ecuación de Van der Waals es una ecuación de estado de un fluido compuesto de partículas con un tamaño no despreciable y con fuerzas intermoleculares, como las [[fuerzas de Van der Waals].Johannes Diderik van der Waals recibió el premio Nobel en 1910 por su trabajo en la ecuación de estado para gases y líquidos, la cual está basada en una modificación de la ley de los gases ideales para que se aproxime de manera más precisa al comportamiento de los gases reales al tener en cuenta su tamaño no nulo y la atracción entre sus partículas.
Una forma de esta ecuación es:
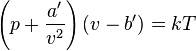
- p es la presión del fluido, medido en atmósferas
- v es el volumen en el que se encuentran las partículas dividido por el número de partículas (en litros)
- k es la constante de Boltzmann
- T es la temperatura, en kelvin
- a' es un término que tiene que ver con la atracción entre partículas
- b' es el volumen medio excluido de v por cada partícula

donde
- p es la presión del fluido
- V es el volumen total del recipiente en que se encuentra el fluido
- a mide la atracción entre las partículas

- b es el volumen disponible de un mol de partículas

- n es el número de moles
- R es la constante universal de los gases ideales,

- T es la temperatura, en kelvin
Fuerzas de Van der Waals
Es la fuerza atractiva o repulsiva entre moléculas (o entre partes de una misma molécula) distintas a aquellas debidas al enlace covalente o a la interacción electrostática de iones con otros o con moléculas neutras. El término incluye:
- fuerzas dipolo permanente-dipolo permanente (fuerzas de Keesom o interacción dipolo-dipolo)
- fuerzas dipolo permanente-dipolo inducido (fuerzas de Debye)
- fuerzas dipolo inducido instantáneo-dipolo inducido (fuerzas de dispersión de London)
Las fuerzas de Van der Waals incluyen a atracciones entre átomos, moléculas, y superficies. Difieren del enlace covalente y del enlace iónico en que están causados por correlaciones en las polarizaciones fluctuantes de partículas cercanas (una consecuencia de la dinámica cuántica). Las fuerzas intermoleculares tienen cuatro contribuciones importantes. En general, un potencial intermolecular tiene un componente repulsivo (que evita el colapso de las moléculas debido a que al acercarse las entidades unas a otras las repulsiones dominan). También tiene un componente atractivo que, a su vez, consiste de tres contribuciones distintas:
- La primera fuente de atracción es la interacción electrostática, también denominada interacción de Keesom o fuerza de Keesom, en honor a Willem Hendrik Keesom.
- La segunda fuente de atracción es la inducción (también denominada polarización electroquímica), que es la interacción entre un ultipolo permanente en una molécula, con un multipolo inducido en otra. Esta interacción se mide algunas veces en debyes, en honor a Peter Debye.
- La tercera atracción suele ser denominada en honor a Fritz London que la denominaba dispersión. Es la única atracción experimentada por átomos no polares, pero opera entre cualquier par de moléculas, sin importar su simetría.
- A distancias de radios de Van der Waals.
Aqui les dejo un pequeño video para aclarar un poco mas acerca de estas fuerzas de van der waals.






